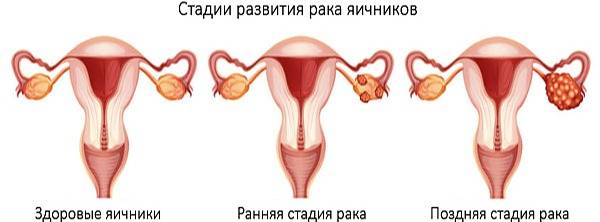
Рак яичников
Рак яичников занимает первое место в структуре смертности от всех гинекологических заболеваний, выживаемость в течение 5 лет не превышает 40% . К сожалению, методов раннего выявления заболевания нет, и попытки разработки эффективных программ скрининга пока не увенчались успехом. В общей популяции риск заболевания составляет около 1,3%. Есть данные об двукратном повышении этого риска среди больных эндометриозом. А вот среди носителей мутации генов BRCA1и BRCA2 риск заболеть раком яичников составляет 44% и 17% соответственно. В связи с высочайшим риском смертельного заболевания среди этой категории граждан в развитых странах применяется тактика профилактических так называемых риск-редуцирующих операций- в виде удаления яичников в возрасте 35-40 лет или 40-45лет. Казалось бы, отличный метод профилактики. Но все не просто…
Результатом риск-редуцирующих операций с удалением придатков матки, особенно в молодом возрасте, является хирургическая менопауза с неизбежными последствиями уже других проблем, связанных с сердечно-сосудистыми рисками, риском остеопороза, снижения ментального здоровья, вульвовагинальной атрофии, снижения качества жизни и т.д. Можно ли повлиять каким- то образом на такой «побочный» эффект «спасения от рака»? Как здесь выбрать оптимальный подход? С одной стороны, мы понимаем, что у носителей мутаций в указанных генах есть высокая вероятность риска как молочной железы, так и яичников, а с другой – не менее грозные последствия в виде повышения сердечно-сосудистых рисков, остеопороза и других проблем при проведении риск-редуцирующих операций.
Пациенты, их родственники, да и вообще все люди должны быть информированы о существовании рисков как таковых, что носители мутаций являются категорией риска рака молочной железы и яичников, и уж потом обсуждать риски, наступающие после выполнения риск-редуцирующих операций. Решение о коррекции этой проблемы должны приниматься совместно врачом и пациентом. Здесь важно взаимное доверие, осознанное информирование. Итак, если перед нами такая пациентка, мы должны объяснить риски, связанные с самой мутацией, репродуктивные проблемы, а также методы компенсации хирургической менопаузы.
Гормональная терапия
Нужно понимать, что первой опцией рассматриваются альтернативные негормональные варианты коррекции менопаузальных симптомов, так как на сегодняшний день недостаточно качественных данных о безопасности применения менопаузальной гормональной терапии для категории пациенток, перенесших риск-редуцирующие операции. Тем не менее, гормональная терапия эстрогенами является разумным вариантом у молодых пациенток, особенно у тех пациенток, которым уже выполнена профилактическая мастэктомия. Однако, ожидаемо, что эстрогенотерапия для категории пациенток с мутациями без мастэктомии повысит риск развития рака молочной железы. Здесь исследователи приводят две схемы приема гормонов: нескольких лет приема менопаузальной гормональной терапии после операции с последующей отменой, или пролонгированный режим до возраста естественной менопаузы, то есть – приблизительно до 50-51года. Существуют исследования, которые показывают, что прием одного эстрогена без прогестинов более безопасен в плане развития рака молочной железы в последующем. Поэтому некоторые исследователи предлагают проведение одномоментной гистерэктомии во время профилактической аднексэктомии. Ведь в таком случае необходимости в приеме комбинированного препарата нет, и можно обойтись монотерапией эстрогенами. Теоретическое обоснование такого подхода также понятен. Ведь если эстрогены в монорежиме не влияют или минимально влияют на риск рака молочной железы по сравнению с комбинированным режимом, то почему бы не убрать матку, где может развиться рак эндометрия. Потенциальной альтернативой такому подходу рассматривается трансдермальная форма эстрогена в сверхнизких дозах, при котором каждые 6-12мес вводится противодействие прогестинами для отторжения эндометрия и профилактики гиперпластических изменений эндометрия.
Высококачественных данных о безопасности менопаузальной гормональной терапии после профилактических аднексэктомй на сегодня нет, но ориентируясь на исследования по данному вопросу можно заключить, что риск рака молочной железы не увеличивается у более молодых носителей мутации BRCA моложе 45лет при приеме менопаузальной гормональной терапии, что нельзя сказать о более старшей возрастной группе, имеющих повышенный риск рака молочной железы при продолжительном приеме до возраста естественной менопаузы.
Какие существуют вообще данные по риску рака молочной железы при менопаузальной гормональной терапии? Таких работ несколько. Наиболее важные данные получены в ходе исследования Инициативы по охране здоровья женщин, которое показало, что применение комбинированной эстроген - прогестагенной терапии привело к значительному увеличению риска развития рака молочной железы у женщин в возрасте старше 50 лет. И наоборот, у женщин на фоне монотерапии эстрогенами не было увеличения риска развития рака молочной железы.
При оценке рандомизированных отдаленных результатов у пациенток с установленным диагнозом рака молочной железы было обнаружено значительное повышение частоты рецидивов рака молочной железы при использовании гормональной терапии и этот риск повышен как для монотерапии эстрогенами, так и для комбинированной терапии. Эта работа является одним из подтверждений того, что при раке молочной железы гормональная терапия противопоказана.
Однако, обобщаемость этих данных для женщин до периода менопаузы, перенесших риск - редуцирующие операции, неясна. Носители мутаций отличаются от популяции пациенток в периоде постменопаузы, так как они более молодого возраста и испытывают хирургическую, а не естественную менопаузу. Также надо понимать, что хотя носители мутации BRCA имеют повышенный риск развития рака молочной железы, их нельзя приравнивать к женщинам, с уже установленным диагнозом рака молочной железы.
Именно в связи с этими противоречиями группа ученых из Нидерландов опубликовала результаты своего исследования по решению проблемы хирургической менопаузы для носителей мутаций. Новая стратегия риск-редуцирующих операций заключается в интервальной операции- выполнение сальпингэктомии после выполнения репродуктивной функции с отсроченной оварэктомией. Теоретическимсеким обоснованием такого подхода является то , что именно маточные трубы играют ключевую роль в канцерогенезе эпителиальных раков, которые являются самой частой среди всех опухолей яичников. Так называемая TUBA study, проспективное мультицентровое исследование, где проведено сравнение исходов обычной тактики аднексэктомии и интервальной операции. Здесь как раз проведена попытка взвесить последствия снижения риска самого рака с одной стороны, и рисков хирургической менопаузы с другой стороны. Исследование продолжается в рамках клиническийх исследований, но на сегодня все большее число пациентов выбирает именно этот метод, так повзяволяет балансировать между двумя рисками.
Планирование беременности при раке яичников
Конечно, риск-редуцирующие операции предлагаются пациентам с реализованной репродуктивной функцией. Носителям мутаций рекомендуется как можно раньше при возможности планировать беременность. Если нет планов на ближайшую репродукцию, то можно обратиться в клиники для витрификации (заморозки) эмбрионов с (или без) преимплантационной генетической диагностикой. Что нужно знать перед планированием беременности в таком случае? Мутации в генах BRCA наследуются по аутосомно-доминантному типу, а это означает, что существует 50-процентная вероятность того, что дети носителей BRCA1 / 2 унаследуют вариант предрасположенности к раку. Репродуктивное консультирование носителей мутаций BRCA1, / 2 включает информирование пациентов о возможностях пренатальной диагностики и вспомогательных репродуктивных технологиях. Преимплантационная генетическая диагностика используется для генетического анализа предварительно полученных путем ЭКО эмбрионов перед их переносом в матку, то есть возможность отбора эмбриона без мутации.
Известно также, что носители мутации гена BRCA2, которые планируют иметь детей от партнера, который также имеет подвержен повышенному риску носителей патогенного варианта высокий риск мутации BRCA2 (например, с из-за анамнезома рака или принадлежности из-за повышенной частоты у лиц к группе еврейского происхождения ашкенази), находятся в риске иметь потомство, которое может унаследовать редкий рецессивный синдром, который характеризуется сочетанием опухолей головного мозга, анемии Фанкони и рака груди. Этот синдром встречается у людей, у которых есть две мутации в BRCA2. Двуаллельные мутации в BRCA1 и других генах также могут предрасполагать к анемии Фанкони и другим тяжелым заболеваниям.
Таким образом, репродуктивные риски и пути их преодоления должны обсуждаться с пациентом. Каждый случай требует индивидуального подхода, и при правильном взаимопонимании между пациентом и врачом можно найти оптимальный ответ на непростые вопросы в области профилактики рака и сопутствующих ему проблем.
